Приведение досье на лекарственный препарат к требованиям ЕАЭС
Все лекарственные препараты зарегистрированные по национальным процедурам до 31 декабря 2020 должны быть приведены в соответствие с требованиями ЕАЭС до 31 декабря 2025 года.
С 1 января 2026 года аннулируются все РУ ( регистрационные удостоверения) на лекарственные препараты, которые не приведены в соответствие с требованиями ЕАЭС.
Не приведённые в соответствие препараты реализуются после 2025 года до окончания их срока годности).
Если препарат зарегистрирован в нескольких странах ЕАЭС, то необходимо выбрать референтное государство для подачи.
Срок действия национального РУ: после приведения в соответствие национальное РУ действует в течение 180 дней и в дальнейшем не требует заявления о прекращении его действия от заявителя.
Эксперты нашей компании выполняют все услуги по приведению досье к требованиям ЕАЭС на лекарственный препарат.
Процесс приведения досье к требованиям ЕАЭС занимает 100 календарных дней. (без учета времени для ответа на запросы).
Заявителю требуется предоставить документы на зарегистрированный лекарственный препарат, по стандартам ЕАЭС.
Нельзя включать новые сведения, которые могут оказать воздействие на:
- качество
- эффективность
- безопасность
В процессе рассмотрения досье, регуляторный орган референтного государства направляет пояснительные запросы в адрес заявителя. На время ответа на запрос действует "стоп тайм"
Стоимость приведения в соответствие досье на ЛП зависит от многих факторов.
Для первичного ознакомления с проектом по приведению досье к требованиям ЕАЭС мы просим предоставить следующую информацию:
-
Наименование лекарственного препарата (международное непатентованное или химическое и торговое наименование)
-
Состав лекарственного препарата
-
Лекарственная форма, дозировка, способы введения и применения
-
Описание фармакологических и фармакодинамических или иммунобиологических свойств препарата, область применения, форма выпуска
-
В каких странах получено регистрационное удостоверение (Marketing Authorisation)
- Краткое резюме проведенных доклинических и клинических исследований
На основе анализа данных документов мы подготовим полноценный план мероприятий направленных на приведение досье на ЛП к требованиям ЕАЭС, сформируем бюджет и предоставим консультацию по особенностям процедуры.
Схема приведения досье на ЛП к требованиям ЕАЭС в России. Процедура действует до 31 декабря 2025. 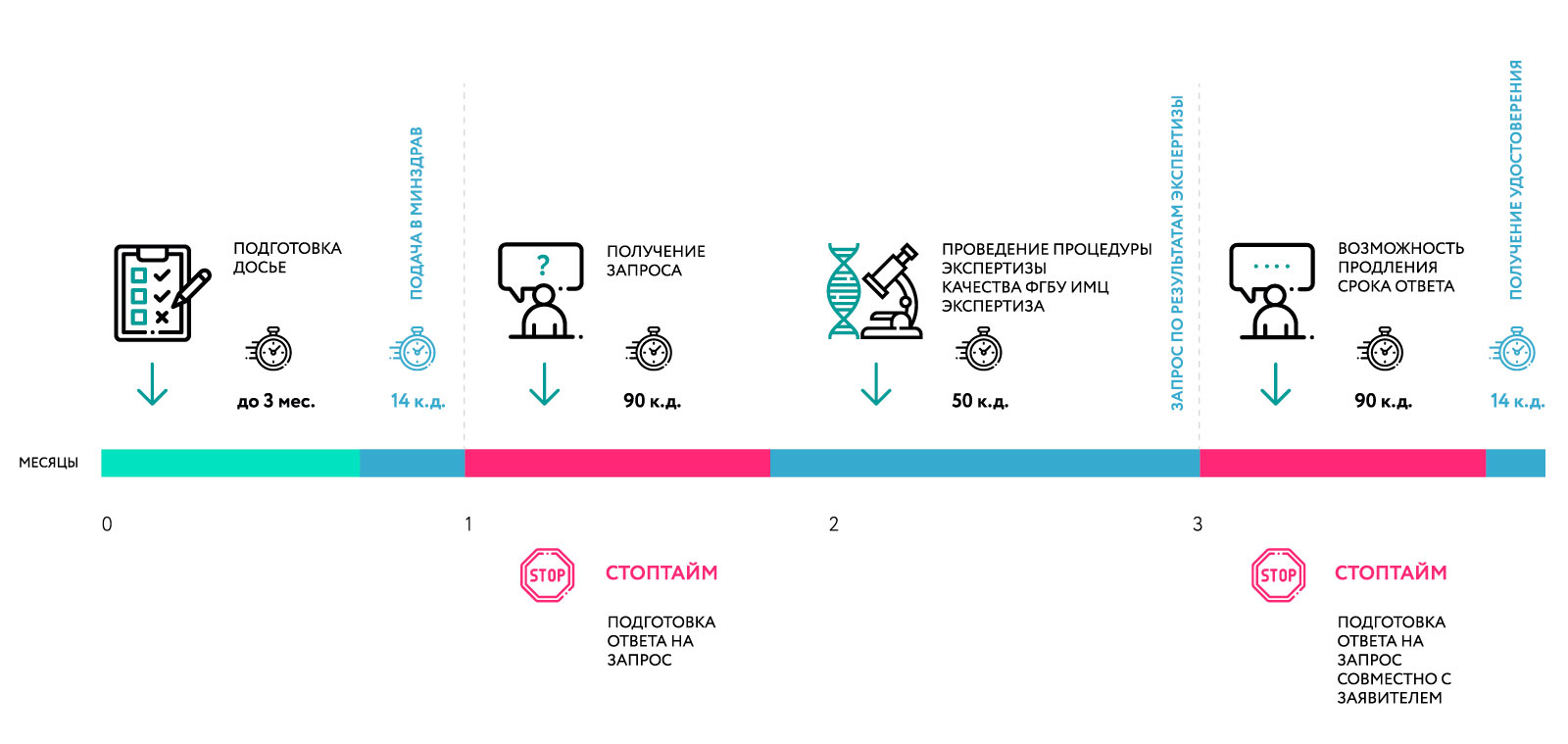
Методы снижения рисков при регистрации лекарственных средств:
-
Предварительные исследования в независимой экспертной организации по методике испытаний заказчика (отработка методики испытаний)
-
Предварительная экспертиза регистрационного досье на лекарственный препарат.
-
Редактирование и доработка нормативной документации (НД) под действующие нормы стандартизации.
В рамках услуги по регистрации лекарственных средств:
-
предварительный расчет образцов и стандартов для проведения экспертизы качества и предварительной экспертизы;
-
заказ стандартных образцов и хроматографических колонок;
-
проведение предварительной экспертизы качества образцов и получение заключений и рекомендаций по предложенным методам анализа;
- формирование XML досье
Наши эксперты оказывают консультационные услуги в области регистрации лекарственных средств уже более 20 лет. Их профессиональный опыт часто помогает нашим заказчикам выбрать оптимальную стратегию своевременной регистрации лекарственных препаратов в условиях переходного периода регуляторной системы к стандартам ЕАЭС.
За годы деятельности по регистрации лекарственных средств и фармацевтических субстанций, анализируя происходящее на рынке консалтинга в сфере обращения лекарственных средств, мы пришли к мнению, что основной задачей для успешной регистрации лекарственного препарата является уменьшение рисков, которое обеспечивается вследствие предварительной оценки каждого проекта и максимального устранения возможных замечаний экспертов уполномоченного на проведение экспертизы лекарственных средств экспертного учреждения.
